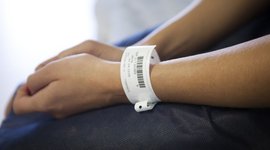
Směrnice UDI
V budoucnu by měl být každý zdravotnický prostředek unikátně značený a identifikovatelný po celém světě. K tomu bude sloužit standardizovaný systém Unikátní Identifikace Zařízení (Unique Device Identification, zkráceně UDI). V celé Evropě je zavedení tohoto značení upraveno nařízením o zdravotnických prostředcích (MDR). Bylo zavedeno již v roce 2017 a nyní postupně vstupuje v platnost. Pro zavedení a implementaci nařízení se používá přístup založený na riziku, tj. nejprve musí být označeny výrobky rizikové třídy III a nakonec výrobky třídy I. To má lépe zajistit bezpečnost pacientů a sledovatelnost a zpětnou dohledatelnost zdravotnických prostředků. Za tímto účelem je každý výrobek opatřen identifikací výrobku ve formě číselného kódu a lineárního nebo 2D čárového kódu. Myšlenka je následující: Číselný kód je čitelný pro člověka, čárový kód pro stroj. Pokud je výrobek velmi malý, postačí i strojově čitelný kód. Požadavky UDI jsou nyní důležitou součástí při posuzování shody pro získání označení CE.
Složky systému značení UDI
Systém UDI se skládá z jedinečné identifikace prostředku, úrovní balení a souvisejících záznamů v databázi. Tím se zvyšuje globální sledovatelnost a identifikace prostředků. To vytváří lepší transparentnost na trhu a zajišťuje rychlejší zpracování nápravných opatření nebo stahování prostředků z trhu, včetně oznámení regulačním orgánům.
UDI-DI & UDI-PI
UDI se skládá ze dvou částí: identifikátoru prostředku (UDI-DI) a identifikátoru výroby (UDI-PI).
První z nich (UDI-DI) slouží k identifikaci prostředku a výrobce a musí být uveden na samotném prostředku, a navíc také na jeho obalu. Přiděluje ho příslušný regulační orgán a je statický. V identifikátoru je obsaženo až 20 datových bodů, jako jsou informace o obchodním názvu, možnosti opakovaného použití, sterilitě atd. Druhý identifikátor (UDI-PI) označuje šarži výrobku, např. číslo várky nebo šarže, sériové číslo, údaje o datu spotřeby nebo výrobní údaje, a přiděluje jej sám výrobce.
Základní UDI-DI
Základní UDI-DI má zvláštní úlohu. Identifikuje podobné produkty se stejným účelem a třídou rizika, které se mírně liší, například výkonem motoru. Jedná se tedy o jakousi identifikaci modelu. Ačkoli funguje jako klíč pro databázi UDI EUDAMED, přesto se neuvádí na produktu ani na obalu, ale výrobci jej uvádějí spolu s dalšími datovými prvky v databázi UDI. Výrobci musí rovněž vést seznam všech přidělených UDI pro každý zdravotnický prostředek. Ten je součástí technické dokumentace.
UDI na obalech
Od roku 2021 musí navíc výrobci zdravotnických prostředků postupně označovat UDI nejen samotné produkty (v závislosti na třídě zdravotnického prostředku), ale také jejich obaly (výjimku tvoří kontejnery). Zde platí následující: Kód musí zůstat čitelný po celou dobu životnosti. To platí pro všechny zdravotnické prostředky.
Značení UDI: důležitý zákonný požadavek, který je však spojen s dodatečnými náklady
Díky směrnici UDI učinila EU významný krok vpřed v oblasti bezpečnosti pacientů v medicínském a farmaceutickém odvětví prostřednictvím jasného značení a úplné sledovatelnosti. Nicméně výrobci mohou narazit na nejrůznější překážky, a implementaci tak lze jen stěží zvládnout bez kompetentního poradenství a zkušeného partnera. Naši odborníci vám proto rádi pomohou s jakýmikoli otázkami a obavami, které můžete mít v souvislosti se značením pomocí UDI.







![[Translate to Czech:] Dauerhafte Kennzeichnungen in der Industrie [Translate to Czech:] Dauerhafte Kennzeichnungen in der Industrie](/fileadmin/_processed_/1/6/csm_header-onmetal-landingpage_85af41d319.jpg)